近年来,非编码RNA研究领域中百花齐放,精彩纷呈。circRNA作为该领域中的新宠自是当仁不让,从NCBI有关于circRNA发表文献来说,一直处于一个持续上升的趋势(下图1)。很多热情高涨的小伙伴们都欲对其一探究竟,却又苦于不知从何下手而着急万分,那么本文则帮助大家更快更好的在circRNA领域占得一席之地。
![1484202826943065647.png X]II()7@)W[P~7Q%@WE)WGT.png](/static/ueditor/jsp/upload/image/20170112/1484202826943065647.png)
circRNA的筛选及验证
显然,到目前为止,circRNA研究领域仍是一个充满了潜力的大宝库。每一个研究领域、研究方向都有发现新的circRNA功能的可能性。因而首先要从你的研究方向入手,找到属于你的circRNA。一般通过高通量的检测手段(芯片或测序),即可筛选到成百上千个在某种特定条件下与疾病特异性表达相关的circRNA。同样,高通量筛选的circRNA验证也是必不可少。
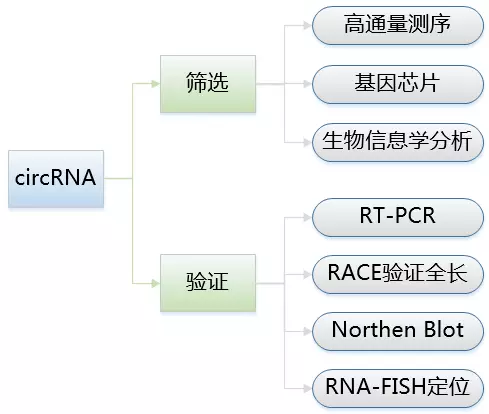
然而,circRNA的RT-PCR验证有其特别之处。常规PCR引物只针对目的片段的上下游进行设计,而circRNA引物可分以下两种方式设计:1)外显子环化circRNA,需要特异性针对剪切位点处(backsplice junction site)来设计primer;2)内含子环化circRNA,可跨剪切位点设计,也可围绕内含子区域设计引物。另外,circRNA引物设计建议还需要满足扩增产物长度不超过100bp;且内参基因不能选用线性mRNA,可采用外参弥补。
![1484202958597048319.png _THUV6{({FLHZGV8T1LN1]Q.png](/static/ueditor/jsp/upload/image/20170112/1484202958597048319.png)
circRNA功能验证
通常只要是你所在研究领域还没有circRNA发表文章,那么鉴定到与疾病表达相关特异性的circRNA,并稍加以验证,1~3分的文章还是可以的。如果再想把文章档次往上提一提,发表3-5分的文章的话,则需要用体内体外实验去验证circRNA的功能。
![1484203053695072447.png 6QUYG1[UJPX]0][4S`[_N43.png](/static/ueditor/jsp/upload/image/20170112/1484203053695072447.png)
circRNA表达的组织特异性验证
此时,可用原位杂交技术(Situ Hybridization)进行验证。设计杂交探针时要跨backsplice junction位点,而后可很清楚的看到circRNA在哪些组织中表达很高,作为组织特性判断的依据。
正向验证——circRNA过表达
目前比较公认的成环机制为circRNA侧翼序列的碱基互补配对,称之为Alu结构。基于此,可用PCR扩增含侧翼Alu序列的目标DNA序列,而后依据相应限制性内切酶位点进行酶切,连接至pEGFP-C1载体中。将连接载体转染相应细胞样本,定量PCR检测转染效率。最后用divergent primer验证circRNA过表达倍数。
![1484203071150019927.png 9E{}]EH$@K5VK$5ACR48YCJ.png](/static/ueditor/jsp/upload/image/20170112/1484203071150019927.png)
过表达策略:1. 扩增目标区域包含circRNA侧翼Alu序列或内部碱基互补序列,侧翼上下游1kb处过表达效率更佳;2. 目标区域扩增基于基因组DNA为模版。
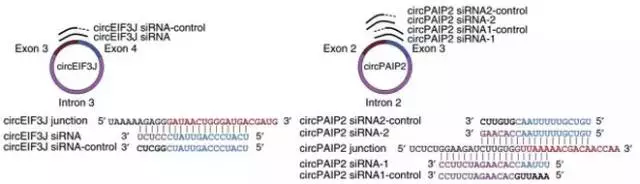
反向验证——circRNA沉默
沉默circRNA,可用siRNA沉默,即针对circRNA 的backsplice junction位点前后序列设计siRNA;而对于内含子环化circRNA,还可针对内含子区域设计相应siRNA。最后利用Divergent primer验证circRNA敲除倍数。此外,每个siRNA设计相应的对照(backsplice junction位点一端互补配对,另一端错配)。
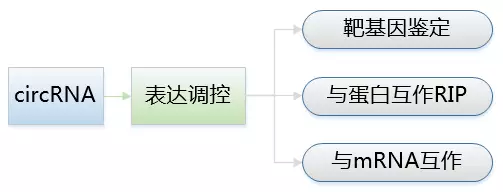
circRNA机制研究
目前针对circRNA的功能机制研究不多,常见的调控基因表达和蛋白合成方式有:1)circRNA能与蛋白质/RNA结合,募集蛋白质复合体的组分或调控基因的表达;2)circRNA可以作为“sponge”海绵吸miRNA,调节靶基因;3)circRNA通过碱基互补配对直接调控其他RNA水平。
一般来说,ceRNA调控机制是circRNA作用机制研究的首选,因而很多文章优先从ceRNA的角度去解释其作用机理。而circRNA作为miRNA的“sponge”有两个基本前提:1)circRNA和mRNA有共同的miRNA结合位点。2)circRNA影响其竞争结合对象mRNA的表达。
首先用RNA-FISH确认circRNA在细胞中的定位。细胞定位是决定调控机制研究方向的关键。转录后调控尤其是ceRNA调控,一般认为在细胞质中进行,如果该circRNA主要定位于细胞质,那么是有可能成为ceRNA分子的。
其次,寻找靶定circRNA的miRNA及miRNA靶定的mRNA。1)利用生物信息学对其进行预测,即通过miRcode/starBase筛选circRNA潜在的miRNA结合位点(MRE),同时通过miRTarBase预测miRNA的靶基因。而后用通过荧光素酶报告系统及免疫共沉淀(RIP)进行验证circRNA和mRNA之间的表达呈正相关性。2)也可直接通过circRNA+mRNA组合芯片高通量筛选,分析差异表达circRNA和mRNA之间的表达相关性分析,寻找与circRNA关系密切的mRNAs
最后,验证circRNA对miRNA及其下游靶基因的表达影响。这部分可通过过表达和沉默circRNA中检测mRNA的变化,过表达和沉默mRNA来检测circRNA的变化以及circRNA和mRNA表达相关性分析加以验证。
举个例子:
1)在细胞中转染miRNA mimics,检测circRNA和突变circRNA的靶基因表达变化。
2)在circRNA敲除细胞系,抑制miRNA的表达;或在circRNA过表达细胞系中,异位表达miRNA,检测能否抵消掉circRNA异常表达引起的生物学变化。
3)构建含有靶基因mRNA 3’UTR区和突变序列的载体,检测在circRNA敲降条件下是否会降低,加以在miRNA sponge的条件下,又是否能够补救;或者在circRNA过表达下,mRNA表达是否会升高,加以miRNA过表达时又是否能够补救。
如此将circRNA研究提升到作用机制的层次,后续在体内做些工作加以验证的话,那么,5分以上甚至10分以上的文章还是很有希望的。
联系方式
山东省济南市章丘区文博路2号 齐鲁师范学院 genelibs生信实验室
山东省济南市高新区舜华路750号大学科技园北区F座4单元2楼
电话: 0531-88819269
E-mail: product@genelibs.com
微信公众号
关注微信订阅号,实时查看信息,关注医学生物学动态。


