编辑推荐:
miRNA通过与mRNA目标结合,抑制其翻译成蛋白质,从而在胚胎发育、细胞分化以及器官形成等过程中发挥重要作用。然而,事情并非如此简单。单个 mRNA可能受到多个miRNA的调控,而单个miRNA能够调控多个mRNA。mRNA与miRNA之间的串扰(crosstalk)是如此复杂,又如 此迷人,引无数学者竞折腰。
miRNA争夺战
2011年,哈佛大学医学院的著名癌症遗传学家Pier Paolo Pandolfi教授提出假说,认为不同类型的RNA分子会争相与miRNA结合,从而减少miRNA对其mRNA目标的抑制作用1。
换句话说,当没有竞争性的转录本存在时,miRNA可能抑制翻译或增强mRNA的降解。当竞争性内源RNA(ceRNA)上调时,ceRNA争先恐后地与共同的miRNA结合,导致mRNA翻译的增加2。
这些竞争性内源RNA可能包括各种类型的RNA转录本,比如环状RNA(circRNA)、长链非编码 RNA(lncRNA)、假基因以及蛋白编码mRNA。它们通过miRNA应答元件(MRE)介导的“语言”来竞争miRNA。根据假说,享有共同MRE 的编码和非编码RNA转录本能够彼此积极地沟通,调节各自的表达水平。
自首次提出以来,Pier Paolo Pandolfi的假说就引起了科学界的轰动。当然,一些研究也对这一理论提出了质疑。,澳大利亚Garvan医学研究所的研究人员全面评估了支持和反对ceRNA假说的各项证据,以评估内源性miRNA海绵的影 响3。
分子机制
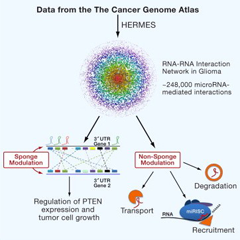
mRNA、假基因、lncRNA和circRNA都可以充当ceRNA,阻止miRNA与蛋白编码mRNA 的相互作用。因此,这些ceRNA也能在ceRNA网络中彼此调节。这种串扰的强度是由多个条件决定的,包括miRNA和目标的相对水平、miRNA结合 位点的数量,以及miRNA与目标或ceRNA结合的强度。
mRNA作为ceRNA。在目前验证过的ceRNA中,大多数是mRNA,它们能够竞争miRNA的结合, 从而调控基因表达。对于磷酸酶和张力蛋白同源基因(PTEN),一个推定的ceRNA是锌指E盒结合同源框2(ZEB2)mRNA。研究证明,ZEB2 mRNA能够隔离共享的miRNA而调控PTEN的表达。在人类黑色素瘤中,ZEB2表达的减弱导致抑癌基因PTEN被抑制。总之,蛋白编码转录本和编码 基因的3’ UTR可能作为miRNA的内源性诱饵,从而调控miRNA的目标,发挥重要的生物活性。
小编在基因云馆中发现了关于PTEN的信息:
PTEN基因(以及对应的蛋白质)的细胞分布位置:细胞核、细胞质、细胞膜、细胞外基质、线粒体。
可能调控PTEN基因的相关microRNA:
hsa-miR-141 hsa-miR-19a hsa-miR-214 等。
点击这里查看关于PTEN基因的详细信息。
lncRNA作为ceRNA。随着lncRNA的数量不断增加,越来越多的研究也开始关注lncRNA在表 观遗传机制及其他生物学过程中的作用。作为天然的miRNA诱饵,lncRNA有望在转录后调控水平充当ceRNA。比如,肌肉特异的lncRNA LINCMD1通过与miR-133和miR-135结合,调节了肌肉分化。这些miRNA通常负向调节转录因子MAML1和MEF2C的表达。因 此,LINCMD1作为miRNA诱饵,激活了MAML1和MEF2C。
小编在基因云馆中发现了关于LINCMD1的信息:
点击这里查看关于LINCMD1的详细信息。
假基因作为ceRNA。在转录组中,假基因也占了相当大的比例。测序显示,假基因内的核苷酸序列得到了很好 的保留,这表明可能存在选择压力来维持这些遗传元件。假基因没有内含子,但与其祖先基因共享了5’和3’ UTR。过表达和RNAi实验证实,假基因PTENP1在转录后通过共享的miRNA调节了PTEN的表达。不过,目前只有极少数假基因经过了功能验证, 还需要更多的证据来支持。
circRNA作为ceRNA。到目前为止,研究最多的circRNA是性别决定Y(SRY)基因产生的, 但这些环状RNA的生物学功能还不清楚。最近,SRY被确定为miR-138的海绵,具有ceRNA活性,表明这些环状RNA可能在RNA调控网络中发挥 重要作用。circRNA已在多种类型的组织中被鉴定出,它们耐受RNase R的处理,且半衰期比线性RNA转录本更长。因此,具有ceRNA活性的circRNA可能是串扰中的有效调节剂。
ceRNA与癌症
其他研究已经证明,ceRNA通过调节关键癌基因或抑癌基因的表达,在癌症发病中扮演重要的角色。
广东医学院的研究人员回顾了近期的研究,表明ceRNA在癌症发展中起作用4。例如,编码RNA和非编码RNA(如lncRNA和假基因转录本)都可以充当ceRNA,诱导细胞增殖失控。
CDC42是一个参与细胞周期的基因,它抑制增殖、集落形成和肿瘤生长。有人推测,CD44 mRNA和CDC42 mRNA竞相与miRNA结合。在上皮性卵巢癌中,CD44的表达上调让CDC42 mRNA从抑制中释放出来,从而导致结果向好的方向发展。与此相反,在Burkitt淋巴瘤、神经母细胞瘤和前列腺癌中,CD44表达的下降伴随着致癌转化。
同样地,HMGA2已被证明通过两种机制促进肺癌形成:作为蛋白编码基因和非编码RNA。HMGA2在转移 性肺腺癌中高表达,它促进了癌症发生和转移。另外,HMGA2通过与TGF-β共受体TGFβR3争夺let-7,也促进了肺癌形成。let-7激活了参 与肺癌发展的TGF-β信号通路。
此外,ceRNA也在细胞生长和增殖中发挥作用。例如,假基因PTENP1与PTEN竞争miRNA的结 合,调节了特定miRNA目标的去阻遏。PTENP1的缺失使得PTEN-miRNA结合增加,降低了PTEN的翻译,从而导致肿瘤抑制功能减弱。 PTENP1基因组拷贝数丢失的存在也支持了PTENP1是肿瘤抑制基因的假说。
研究工具
尽管ceRNA的研究仍处于起步阶段,但它已成为RNA生物学研究的一个新兴领域。可以在整个转录组范围内研究miRNA结合的竞争。
研究人员通常先确定研究对象:癌组织 vs 癌旁组织,用药前后或不同发育阶段的样本,然后通过芯片或新一代测序来筛选差异的miRNA、lncRNA和mRNA等。他们可以借助测序平台来开展 small RNA-Seq,以测定miRNA的丰度,或利用Sensor-seq来测定miRNA的活性。他们也可以利用Affymetrix的基因芯片来开展分 析。
对于miRNA表达谱分析,QIAGEN提供了一套专门设计的产品,miScript PCR System能克服与循环miRNA定量相关的挑战。同样地,human RT² lncRNA PCR Array也为循环lncRNA的定量提供了一个解决方案。
之后,研究人员可利用生物信息学方法对ceRNA调控网络进行预测。当然,验证工作也必不可少。大家可以在蛋白水平和RNA水平验证ceRNA对目的基因的影响,以及ceRNA对miRNA的依赖性,并在细胞水平和动物模型中完成功能验证。
总的来说,目前发现的ceRNA还比较少。在未来的研究中,我们一方面需要找到更多的ceRNA,另一方面需要探索ceRNA串扰是否是一个大型的RNA转录调控网络。通过ceRNA的研究,人们有望发现癌症及其他疾病的标志物,并为癌症治疗提供新的视角。
MAML1基因(以及对应的蛋白质)的细胞分布位置:细胞核
可能调控MAML1基因的相关microRNA:
hsa-miR-124
hsa-miR-197
hsa-miR-92a
点击这里查看关于MAML1基因的信息。
MEF2C基因(以及对应的蛋白质)的细胞分布位置: 细胞核、细胞质。
可能调控MEF2C基因的相关microRNA:
hsa-miR-26b hsa-let-7c hsa-let-7c* 等。
点击这里查看关于MEF2C基因的详细信息。
参考文献
1. Salmena, L., Poliseno, L., Tay, Y., Kats, L. and Pandolfi, P.P. (2011). A ceRNA hypothesis: the Rosetta Stone of a hidden RNA language? Cell 146,353–8.
2. de Giorgio, A., Krell, J., Harding, V., Stebbing, J. and Castellano, L. (2013) Emerging roles of competing endogenous RNAs in cancer: insights from the regulation of PTEN. Mol Cell Biol. 33, 3976–3982.
3. Thomson, D.W. and Dinger, M.E. (2016) Endogenous microRNA sponges: evidence and controversy. Nat Rev Genet. 17, 272–83.
4. Dai, Q., Li, J., Zhou, K. and Liang, T. (2015) Competing endogenous RNA: A novel posttranscriptional regulatory dimension associated with the progression of cancer. Oncol Lett. 10, 2683–2690.
微信公众号
关注微信订阅号,实时查看信息,关注医学生物学动态。


