编辑推荐:
来自康奈尔大学的研究人员在新研究中确定了SIRT6脱脂酰基转移酶活性的功能贡献。
2016年3月,林和宁教授领导康奈尔大学的研究人员开发出了一种酶抑制剂,证实能够有效地对抗多种癌症,其中最为显著的是白血病、乳腺癌和大肠 癌。借助一种叫做TM(thiomyristoyl lysine)的化合物,研究小组能够抑制实验室乳腺癌小鼠模型中的SIRT2,降低c-Myc蛋白水平,并抑制肿瘤生长。
白血病是一类造血干细胞恶性克隆性疾病。克隆性白血病细胞因为增殖失控、分化障碍、凋亡受阻等机制在骨髓和其他造血组织中大量增殖累积,并浸润其他组织和器官,同时正常造血受抑制。临床可见不同程度的贫血、出血、感染发热以及肝、脾、淋巴结肿大和骨骼疼痛。据报道,我国各地区白血病的发病率在各种肿瘤中占第六位。
女性乳腺是由皮肤、纤维组织、乳腺腺体和脂肪组成的,乳腺癌是发生在乳腺腺上皮组织的恶性肿瘤。乳腺癌中99%发生在女性,男性仅占1%。
2016年4月,林和宁研究小组与瑞士的科学家合作,确定了一个蛋白质——SIRT5与健康的心脏功能之间存在一种密切的联系。SIRT5能够删除 一个有害的蛋白质修饰,称为赖氨酸琥珀酰化,它剥夺了心脏有效燃烧脂肪酸生成抽动所需能量的能力。
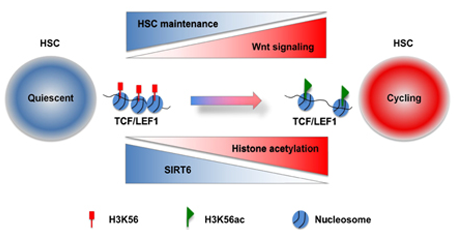
SIRT6是沉默信息调节蛋白家族成员之一,具有NAD+依赖的蛋白去酰化酶和ADP核糖基转移酶等多种酶活性,主要定位在细胞核。其在机体的生 理、病理过程中具有重要的调控作用,参与调控机体寿命与衰老、癌症、肥胖、胰岛素抵抗及炎症反应等过程。但目前尚不清楚SIRT6每种活性对于各种功能的 贡献。
2013年,林和宁教授与香港大学的郝權教授合作,揭示了一个为生物学家们所熟知的衰老相关酶SIRT6从所未知的新功能。这一研究发现有可能推动 科学家们更深入地认识机体免疫反应相关信号分子,帮助治疗类风湿关节炎和癌症等疾病。
SIRT6基因(以及对应的蛋白质)的细胞分布位置:细胞核、细胞质。
可能调控SIRT6基因的相关microRNA:
hsa-miR-33b hsa-miR-33B*
点击这里查看SIRT6的相关疾病
SIRT6基因的相关文献有:慢性阻塞性肺疾病Sirtuins的研究进展等。点击这里查看相关文献。
研究人员发现了在体外具有有效脱脂酰基转移酶活性而脱乙酰酶活性显著降低,在细胞中检测不到脱乙酰酶活性的SIRT6突变体(G60A)。 这种G60A突变体结合NAD+能力降低,但在存在脂肪酰基赖氨酸肽的情况下可以恢复NAD+结合,说明保留了脱脂酰基转移酶活性。利用这一突变体,研究 人员证实SIRT6的脱脂酰基转移酶活性调控了许多蛋白的分泌。值得注意地是,敲除Sirt6的小鼠胚胎成纤维细胞通过外泌体(exosome)分泌了许 多核糖体蛋白,相比于对照外泌体,这些外泌体提高了NIH 3T3细胞的增殖。
这些研究数据表明SIRT6不同的活性调控了不同的信号通路,G60A突变体是研究脱脂酰基转移酶活性对其各自功能贡献的一个有用工具。这一研究为研究脱脂酰基转移酶活性对其各自功能做出了巨大的贡献。
推荐原文摘要:
Identifying the functional contribution of the defatty-acylase activity of SIRT6
Mammalian sirtuin 6 (SIRT6) exhibits many pivotal functions and multiple enzymatic activities, but the contribution of each activity to the various functions is unclear. We identified a SIRT6 mutant (G60A) that possesses efficient defatty-acylase activity but has substantially decreased deacetylase activity in vitro and no detectable deacetylase activity in cells. The G60A mutant has a decreased ability to bind NAD+, but the presence of fatty-acyl lysine peptides restores NAD+ binding, explaining the retention of the defatty-acylase activity. Using this mutant, we found that the defatty-acylase activity of SIRT6 regulates the secretion of numerous proteins. Notably, many ribosomal proteins were secreted via exosomes from Sirt6 knockout mouse embryonic fibroblasts, and these exosomes increased NIH 3T3 cell proliferation compared with control exosomes. Our data indicate that distinct activities of SIRT6 regulate different pathways and that the G60A mutant is a useful tool to study the contribution of defatty-acylase activity to SIRT6's various functions.
微信公众号
关注微信订阅号,实时查看信息,关注医学生物学动态。


